מערכת הקפאת הסרטן של אייסקיור נכנסת להליך אישור מואץ ב-FDA
מנהל המזון והתרופות האמריקאי הכיר במערכת של אייסקיור הישראלית כ"מכשור פורץ דרך", כך שהליך קבלת האישור שלה יקוצר; המניה מגיבה בזינוק של 30% בבורסת תל אביב
מנהל המזון והתרופות האמריקאי (FDA) הכיר במערכת של חברת אייסקיור מדיקל הישראלית כ"מכשור פורץ דרך". כך דיווחה הבוקר (א') אייסקיור, שמפתחת את מערכת ProSense להשמדת גידולים שפירים וסרטניים באמצעות הקפאתם.
- הקצאה הפרטית באייסקיור ודילמת בעלי מניות המיעוט
- עם שעון יד על הדופק: קארדיאקסנס תנפיק בת"א לפי שווי 450 מיליון שקל
- הסכם ראשון ל-MeMed הישראלית עם יצרנית בינ"ל למכשור רפואי
בתגובה להודעה, מזנקת מניית החברה ב-30% היום בצהריים, במחזור גבוה של 8.5 מיליון שקל לעומת מחזור יומי ממוצע של מיליון שקל במניית אייסקיור בשנה האחרונה.
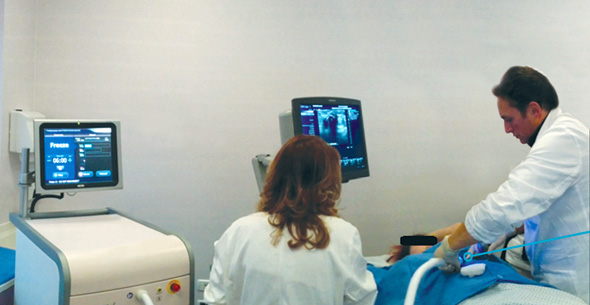 הליך הקפאת גידול באמצעות המערכת של אייסקיור צילום: אייסקיור
הליך הקפאת גידול באמצעות המערכת של אייסקיור צילום: אייסקיור
ההכרה של ה-FDA ב-ProSense כמכשור פורץ דרך, תאפשר לחברה להיכנס לדיון מזורז ולהאיץ את התהליכים לקבלת אישור ה-FDA המיוחל.
אייל שמיר, מנכ"ל אייסקיור, ציין כי "קבלת מעמד של מכשור פורץ דרך מאפשר לחברה גישה ישירה לצוות ה-FDA שבוחן את המוצר ובכך מקצר את תהליך הבקשה לאישור המוצר.
"על פי הערכות בכל שנה ישנם כ-280 אלף מקרים חדשים של סרטן שד בארה"ב, מתוכם מערכת ProSense מיועדת לטפל במקרים של סרטן שד בשלב מוקדם וסיכון נמוך (T1) ו/או במטופלות אשר אינן מתאימות לפרוצדורה ניתוחית. אישור זה הוא אבן דרך משמעותית לחברה שכן הוא מהווה הכרה רגולטורית חשובה בצורך הקליני הנותר ללא מענה במגוון אינדיקציות לרבות סרטן השד בשוק היעד העיקרי שלנו בארה"ב".
בסוף החודש צפוי ד"ר ריצ'רד פיין, ראש מחלקת סרטן שד בביה"ח ווסט קליניק ממפיס, שבטנסי, להציע מצגת עדכון בנוגע לניסוי שעורכת החברה (ניסוי המכונה ICE3) בכנס השנתי של האגודה האמריקאית למנתחי השד (ASBrS) לשנת 2021. ד"ר פיין כיהן בעבר כיו"ר הארגון.























